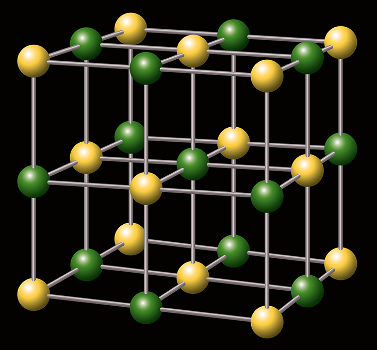
O que é sal hidratado?
Para saber o que é sal hidratado, é necessário entender que esse composto iônico é formado pela incorporação de moléculas de água a um retículo cristalino preexistente.
Escrito por: Diogo Lopes Dias
Professor de Química.
Deseja fazer uma citação?
DIAS, Diogo Lopes.
"O que é sal hidratado?"; Brasil Escola.
Disponível em: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-sal-hidratado.htm. Acesso em 03 de
fevereiro
de 2026.
Copiar
Artigos Relacionados
O que são sais inorgânicos?
O que são sais inorgânicos? Trata-se de compostos iônicos formados por cátions e ânions que apresentam inúmeras aplicações.O que é mol?
O mol é uma unidade pertencente ao Sistema Internacional (SI) usada para determinar a quantidade de matéria presente em um sistema.O que é um sal duplo?
Para entender o que é um sal duplo, deve-se saber que se trata de uma substância inorgânica composta por dois cátions e um ânion ou por dois ânions e um cátion.Nomenclatura de sais hidratados
A nomenclatura de sais hidratados envolve o conhecimento de cátions, ânions e do prefixo que indica a quantidade de água presente no sal.Sulfatos
Os sulfatos são sais inorgânicos derivados do ácido sulfúrico que possuem o ânion sulfato (SO42-) ligado a um ou mais elementos metálicos, formando compostos iônicos.Classificação dos Sais
Mol e número de Avogadro: qual a relação?
Nomenclatura dos sais
A nomenclatura dos sais é realizada por meio de regras estabelecidas pela Iupac.Exercícios sobre nomenclatura de sais hidratados
Para resolver estes exercícios sobre nomenclatura de sais hidratados, você deve saber construir o nome do sal a partir da fórmula, bem como criar a fórmula a partir do nome.
Correção de redação Enem gratuita!
Corrigir agora!
Ferramentas
Cronograma de estudos
Jornada do Enem
Corrige Aqui
Conversor de números romanos
Tire Dúvidas
Calculadora SISU
Calculadora PROUNI
Jogo das Capitais
Palpites
Simulados Enem
Simulados Vestibulares