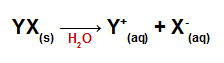O que são sais inorgânicos?
O que são sais inorgânicos? Trata-se de compostos iônicos formados por cátions e ânions que apresentam inúmeras aplicações.
Escrito por: Diogo Lopes Dias
Professor de Química.
Deseja fazer uma citação?
DIAS, Diogo Lopes.
"O que são sais inorgânicos?"; Brasil Escola.
Disponível em: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-sais-inorganicos.htm. Acesso em 03 de
fevereiro
de 2026.
Copiar
Artigos Relacionados
O que é base?
Base é uma substância que, quando em água, sofre dissociação e pode ser classificada quanto à força (forte ou fraca) e à solubilidade (solúvel, pouco ou praticamente insolúvel)O que é sal hidratado?
Para saber o que é sal hidratado, é necessário entender que esse composto iônico é formado pela incorporação de moléculas de água a um retículo cristalino preexistente.O que é ácido forte?
Ácidos fortes são substâncias que, quando adicionadas à água, são capazes de produzir, por meio de ionização, cátion hidrônio e um ânion qualquer.O que é óxido?
Óxidos são substâncias inorgânicas binárias que apresentam o oxigênio como elemento mais eletronegativo. São classificados em anfóteros, ácidos, básicos, neutros ou duplos.Equações de dissociação de sais inorgânicos
As equações de dissociação de sais inorgânicos retratam o cátion e o ânion que formam essas substâncias.Sulfatos
Os sulfatos são sais inorgânicos derivados do ácido sulfúrico que possuem o ânion sulfato (SO42-) ligado a um ou mais elementos metálicos, formando compostos iônicos.Nitratos
Os nitratos são compostos que possuem em sua constituição o íon nitrato. São utilizados como conservantes, fertilizantes, na medicina e na fabricação de explosivos.Cloretos
Os cloretos são compostos iônicos formados pela ligação do ânion cloreto (Cℓ-1) com algum elemento menos eletronegativo do que ele.Carbonatos
Os carbonatos são sais inorgânicos e minerais que contêm o ânion bivalente carbonato (CO3-2). Dois exemplos são o carbonato de sódio (barrilha) e o de cálcio (calcário).Funções inorgânicas
Para facilitar o estudo dos compostos inorgânicos, foram criadas as funções inorgânicas, ou seja, grupos de famílias de compostos com características e propriedades semelhantes.Reações de dupla troca
Sais minerais e vitaminas
Sal Light
Sais no cotidiano
Cloreto de sódio, bicarbonato de sódio e Iodeto de sódio são alguns dos importantes sais que encontramos em nosso cotidiano.
Correção de redação Enem gratuita!
Corrigir agora!
Ferramentas
Cronograma de estudos
Jornada do Enem
Corrige Aqui
Conversor de números romanos
Tire Dúvidas
Calculadora SISU
Calculadora PROUNI
Jogo das Capitais
Palpites
Simulados Enem
Simulados Vestibulares