Considere o seguinte equilíbrio químico a uma temperatura constante:
Não pare agora... Tem mais depois da publicidade ;)
3 H2(g) + N2(g) ↔ 2 NH3(g)
Segundo Gay-Lussac, a proporção de volumes dos participantes gasosos de uma reação é igual à relação dos respectivos coeficientes estequiométricos. Em termos simples, podemos dizer que o número de moléculas presentes nos reagentes e nos produtos é igual aos coeficientes da equação.
No caso acima, nos reagentes temos 4 moléculas e nos produtos temos 2 moléculas, o que significa que o volume dos reagentes é maior e o dos produtos, menor.
Se aumentarmos a pressão desse sistema, o equilíbrio se deslocará no sentido do menor volume para diminuir essa pressão. No caso da reação que estamos considerando, o deslocamento será no sentido direto de formação do produto (NH3(g)).
No entanto, se diminuirmos a pressão, a reação se deslocará no sentido do maior volume, que é o sentido inverso, de formação dos reagentes (3 H2(g) + N2(g)).
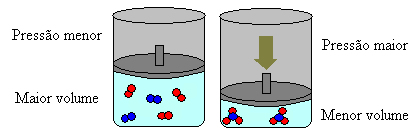
Isso acontece segundo o Princípio de Le Chatelier, que diz que qualquer perturbação (como diminuir ou aumentar a pressão) causada em um sistema em equilíbrio fará com que ele se desloque no sentido que minimize essa perturbação, reajustando-se a um novo equilíbrio.
Não pare agora... Tem mais depois da publicidade ;)
Resumidamente, podemos dizer o seguinte no caso da influência da variação da pressão sobre o equilíbrio químico:
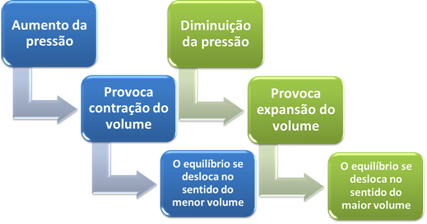
No caso de reações em que o volume dos reagentes é igual ao volume dos produtos, o equilíbrio químico não sofre deslocamento.
Por Jennifer Fogaça
Graduada em Química



