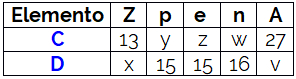
O número atômico, simbolizado pela letra Z, corresponde à quantidade de prótons existentes no núcleo do átomo de determinado elemento químico. Por exemplo, o número atômico do hidrogênio é 1, o que significa que ele possui somente 1 próton em seu núcleo atômico.
Não pare agora... Tem mais depois da publicidade ;)
O número atômico costuma aparecer ao lado do símbolo do elemento químico subscrito (no canto inferior) à esquerda. Exemplo: 1H.
No estado fundamental, o número atômico é igual à quantidade de elétrons, tendo em vista que nesse estado o elemento é neutro, portanto, a quantidade de cargas positivas (prótons) precisa ser igual à quantidade de cargas negativas (elétrons) do átomo.
O número atômico é importante porque é ele que determina as principais características e propriedades do elemento, além do seu comportamento e localização na Tabela Periódica. Os elementos estão alistados na Tabela Periódica em ordem crescente de número atômico, que geralmente aparece acima do elemento, como mostrado abaixo. Veja que o primeiro elemento é o hidrogênio, H (Z= 1), seguido do hélio, He (Z=2), depois vem o lítio, Li (Z = 3), e assim sucessivamente.

Número atômico dos elementos na Tabela Periódica
Inclusive, podemos conceituar um elemento químico como sendo “um conjunto de átomos que possui o mesmo número atômico”. Desse modo, quando falamos, por exemplo, no elemento químico oxigênio, estamos falando dos átomos com número atômico 8. Abaixo temos os átomos dos elementos químicos dos períodos 1 e 2 da Tabela Periódica em ordem crescente de número atômico:
Não pare agora... Tem mais depois da publicidade ;)
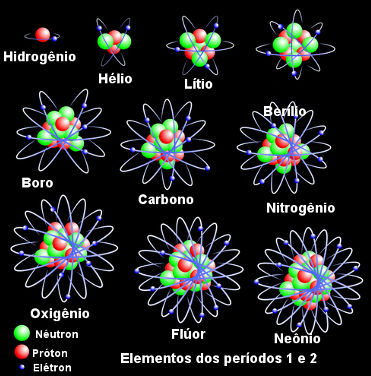
Elementos químicos dos períodos 1 e 2 da Tabela Periódica em ordem crescente de número atômico
Os números atômicos foram definidos inicialmente pelo físico inglês Henry Gwyn Jeffreys Moseley (1887-1915), sendo que ao realizar experiências envolvendo o bombardeamento de vários elementos químicos com raios X, ele observou que a raiz quadrada da frequência dos raios X produzidos pela emissão do núcleo atômico era diretamente proporcional ao número atômico do elemento na Tabela Periódica. Com isso, ele concluiu que o número atômico estava relacionado com as propriedades dos átomos porque representava o número de cargas positivas no núcleo de cada átomo.
As ligações químicas não afetam o número atômico dos átomos, pois elas envolvem somente os elétrons que estão na eletrosfera. No entanto, as reações nucleares envolvem o núcleo atômico e, consequentemente, o número atômico está incluído também.
Por exemplo, quando partículas (principalmente os nêutrons moderados) são bombardeadas sobre um núcleo atômico pesado e instável, esse núcleo é quebrado e origina dois núcleos atômicos menores, ou seja, com um número de prótons e nêutrons menor, liberando uma quantidade colossal de energia.
Já a fusão nuclear é o processo contrário, é quando dois núcleos pequenos e leves unem-se, originando um núcleo maior e mais estável, liberando uma quantidade ainda maior de energia.
Assim, sempre que ocorrem essas reações nucleares, originam-se novos elementos químicos, pois os números atômicos dos elementos iniciais são diferentes dos números atômicos dos elementos finais. Por exemplo, veja abaixo que a fissão do urânio-235 de número atômico 92 dá origem ao bário (Z = 56), ao criptônio (Z = 36) e a três nêutrons:
Não pare agora... Tem mais depois da publicidade ;)
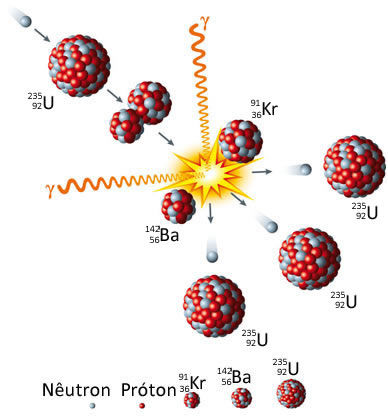
Reação de fissão nuclear do urânio-235
Por Jennifer Fogaça
Graduada em Química