O núcleo atômico é a região central do átomo, apresentando caráter positivo e concentrando quase toda totalidade da massa do átomo. Tal região foi proposta, pela primeira vez, em 1911, através dos estudos do cientista neozelandês Ernest Rutherford. O núcleo atômico é composto por duas partículas subatômicas: prótons e nêutrons.
O núcleo atômico possui caráter positivo, uma vez que os prótons têm carga positiva, e os nêutrons não possuem carga. É destacado pela sua imensa densidade, já que corresponde a 0,01% do átomo, mas concentra mais de 99,9% da massa do mesmo. O núcleo atômico é mantido coeso por meio de forças atratativas conhecidas como força forte.
Leia também: Afinal, o que é átomo?
Tópicos deste artigo
- 1 - Resumo sobre o núcleo atômico
- 2 - O que é núcleo atômico?
- 3 - Características do núcleo atômico
- 4 - Composição do núcleo atômico
- 5 - Função do núcleo atômico
- 6 - Estrutura do átomo
- 7 - Exercícios resolvidos sobre núcleo atômico
Resumo sobre o núcleo atômico
- O núcleo atômico é a região central do átomo.
- Ele apresenta, na sua constituição, os prótons e os nêutrons.
- Ele apresenta caráter positivo, uma vez que os prótons possuem carga positiva, e os nêutrons são neutros.
- O núcleo atômico é reconhecido por sua grande densidade, concentrando quase toda a massa do átomo.
- Ele é mantido por meio de forças atrativas, conhecidas como força forte.
O que é núcleo atômico?

O núcleo atômico é a região central do átomo, de caráter positivo e que concentra praticamente toda a massa do átomo. Ele foi descoberto após os experimentos de Ernest Rutherford, em 1911, e, posteriormente, percebeu-se que seria composto por duas partículas subatômicas: prótons e nêutrons.
Confira também: Como era o modelo atômico de Ernest Rutherford?
Características do núcleo atômico
O núcleo atômico possui, na maioria dos átomos, o formato esférico, embora existam casos de pequenos desvios dessa esfericidade, com maior achatamento ou alongamento.
O que mais chama atenção acerca da natureza do núcleo é sua elevada densidade, uma vez que tal região corresponde a menos de 0,01% do volume atômico, mas é responsável por mais de 99,9% de sua massa. Alguns cálculos apontam que tal densidade é na faixa de 2 x 1017 kg/m3 (a densidade da água, para se ter noção, é igual a 103 kg/m3). Se, por exemplo, a Lua apresentasse tal densidade, ela conseguiria ser alocada dentro de um estádio de futebol.
Como o núcleo possui cargas positivas (prótons) e cargas neutras (nêutrons), entende-se que exista uma força atrativa que o mantenha coeso, maior do que as repulsões próton-próton de natureza coulômbica. Essa força atrativa funciona da mesma forma sobre um par de núcleons (partículas do núcleo, ou seja, prótons e nêutrons), assim, tem-se que considerar que a força atrativa nêutron-nêutron é igual à força atrativa nêutron-próton e, por conseguinte, próton-próton. Essa força atrativa é chamada de força forte e só afeta certos tipos de partículas subatômicas (os hádrons, que incluem prótons e nêutrons, mas não os elétrons), quando estas estão em uma distância da ordem de 2 fm (2 x 10−15 m). Para uma distância maior, ela torna-se pouco significativa, para distâncias menores, ela torna-se repulsiva.
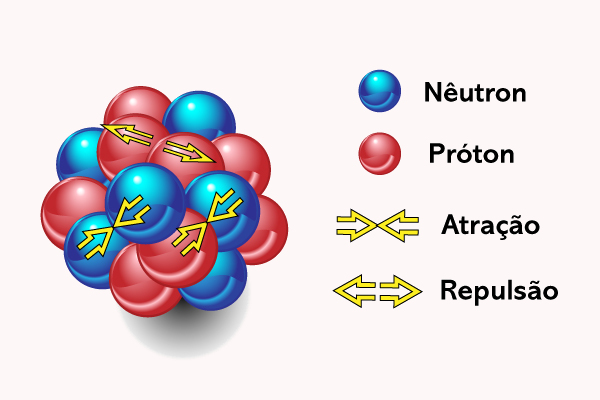
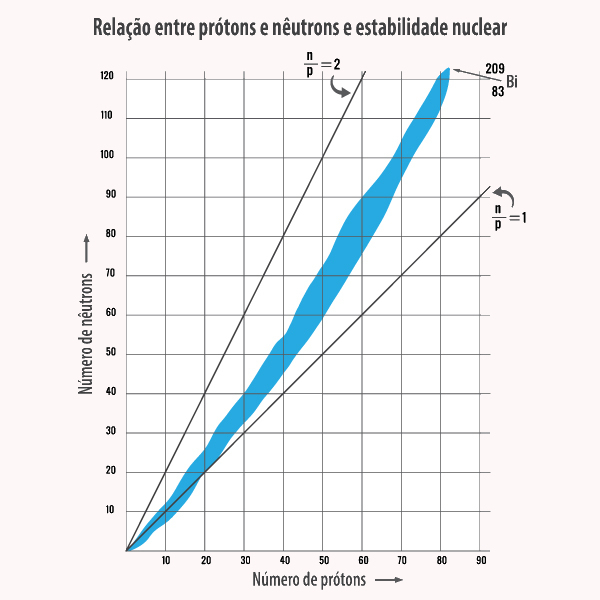
Contudo, apesar da força forte, existem também núcleos atômicos instáveis, os quais decam ou desintegram espontaneamente, formando um novo núcleo, em um fenômeno conhecido como radioatividade. Na verdade, o número de núcleos instáveis supera, em muito, o número de núcleos estáveis conhecidos. Das observações acerca da estabilidade nuclear, podemos concluir, basicamente, que:
- núcleos estáveis (em especial, os mais leves) tendem a ter o número de prótons igual ao número de nêutrons;
- para núcleos de maior massa, percebe-se que o número de nêutrons supera o número de prótons;
- não existem núcleos estáveis em que o número de prótons é maior que 83;
- a maioria dos núcleos atômicos estáveis possui números pares de prótons e de nêutrons, e, do lado oposto, uma quantidade muito pequena de núcleos atômicos estáveis possui números ímpares de prótons e de nêutrons.
Conforme o núcleo torna-se maior, as forças repulsivas entre prótons começam a tornar-se mais significativa também, o que permite um maior afastamento deles, enfraquecendo, assim, a força forte. Por isso, entende-se a maior presença de nêutrons no núcleo, de modo que os prótons estejam mais próximos aos nêutrons, minimizando, assim, as forças eletrostáticas repulsivas e mantendo as forças forte atrativas.
Composição do núcleo atômico
O núcleo atômico é composto de duas partículas subatômicas: prótons, de caráter positivo, e nêutrons, que possuem carga neutra. As características dessas duas partículas estão dispostas na tabela a seguir.
|
Partícula |
Natureza da carga elétrica Não pare agora... Tem mais depois da publicidade ;)
|
Massa (em kg) |
Massa (em u.m.a) |
|
Próton |
Positiva |
1,673 x 10−27 |
1,007 Não pare agora... Tem mais depois da publicidade ;)
|
|
Nêutron |
Neutra |
1,675 x 10−27 |
1,009 |
u.m.a = unidade de massa atômica
Portanto, percebe-se que o nêutron possui uma massa um pouco maior que o próton. A razão entre as massas dessas partículas é igual a 1,001.
Veja também: O que são os elétrons?
Função do núcleo atômico
As partículas presentes no núcleo são de grande importância para a caracterização do átomo. O número atômico (Z), por exemplo, é igual à quantidade de prótons no núcleo e é utilizado para identificar à qual elemento químico o átomo pertence. Outro parâmetro importante para o átomo é a determinação do número de massa (A), que é igual à quantidade de partículas presentes no núcleo, ou seja, ao somatório do número de prótons e de nêutrons.
Por fim, o núcleo também tem a função de manter o átomo coeso, já que a carga positiva do núcleo atrai a carga negativa dos elétrons, mantendo-os em suas respectivas posições na eletrosfera.
Estrutura do átomo
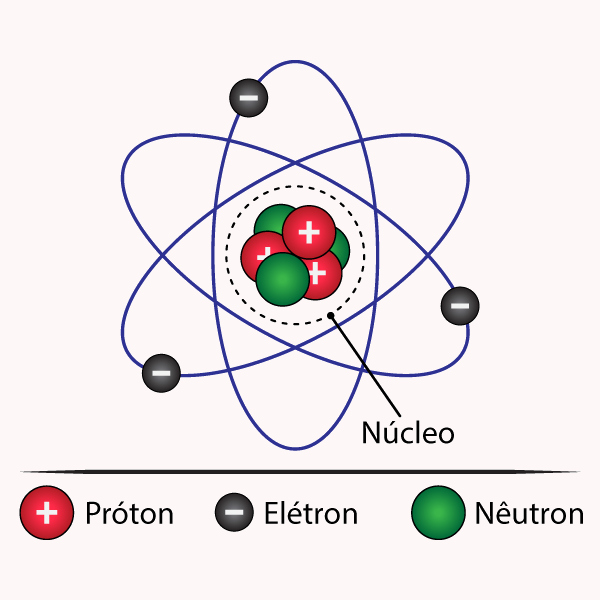
Diante da compreensão atual do átomo, entende-se que a estrutura do átomo possui duas regiões básicas: o núcleo e a eletrosfera. No núcleo, estão os prótons, de carga positiva, e os nêutrons, que possuem carga neutra. Na eletrosfera, estão os elétrons, de carga negativa.
Os prótons e os nêutrons são responsáveis por mais de 99,9% da massa do átomo, uma vez que eles possuem uma massa que é cerca de 1836 vezes a massa do elétron. O átomo, contudo, é eletricamente neutro em seu estado fundamental, ou seja, para cada próton, há também um elétron.
Acesse também: Estrutura atômica — mais detalhes sobre a estrutura do átomo
Exercícios resolvidos sobre núcleo atômico
Questão 1
(Ufla) Ao digitar a palavra “átomo” em um site de buscas na internet, um estudante obteve a seguinte definição:
“O átomo é a unidade básica de construção da matéria. Sua estrutura possui um núcleo, onde ficam prótons e nêutrons, e uma ampla região em torno dele, constituída por elétrons.”
Essa definição sobre o termo “átomo” está relacionada a qual modelo atômico?
A) Dalton
B) Rutherford
C) Thomson
D) Demócrito
Resolução:
Alternativa B.
O núcleo atômico foi proposto em 1911, pelo cientista Ernest Rutherford, que desenvolveu um modelo atômico conhecido como Sistema Solar, em que os elétrons orbitam o núcleo como os planetas orbitam o Sol.
Questão 2
(Univag) Leia o texto para responder à questão.
O elemento lítio possui diversas aplicações. Na natureza, está presente em algumas águas minerais e em minerais como a lepidolita e o espodumênio. Esse elemento possui dois isótopos naturais: o isótopo 7Li, o mais abundante (92,5%), e o isótopo 6Li, o menos abundante (7,5%).
Na forma metálica, o lítio reage violentamente com água produzindo hidróxido de lítio (LiOH) e hidrogênio (H2), que é um gás totalmente inflamável.
Na forma medicamentosa, o carbonato de lítio (Li2CO3) é o princípio ativo de remédios para o controle da psicose maníaco-depressiva.
O número de nêutrons do isótopo mais abundante do lítio é
A) 3.
B) 4.
C) 2.
D) 1.
E) 5.
Resolução:
Alternativa B.
O lítio (Li) possui 3 prótons no núcleo e, portanto, um número atômico igual a 3. O número de massa do isótopo mais estável é igual a 7, e é sabido que o número de massa (A) de um átomo é igual ao somatório do número de prótons e de nêutrons. Sendo assim:
A = p + n
7 = 3 + n
n = 4
Fontes
KÓNYA, J.; NAGY, N. M. Basic Concepts. In: Nuclear and Radiochemistry. 2a ed. Cap. 2, p. 11-24, Amsterdã, Holanda: Elsevier, 2018.
NIST STANDART REFERENCE DATABASE. CODATA Internationally recommended 2018 values of the Fundamental Physics Constants. Disponível em: https://physics.nist.gov/cuu/Constants/index.html
UNIVERSITY OF NORTH IOWA. Structure of Atomic Nuclei. Disponível em: https://faculty.chas.uni.edu/~shand/Mod_Phys_Lecture_Notes/Chap8_Structure_Atomic_Nuclei_Notes_s12.pdf.

