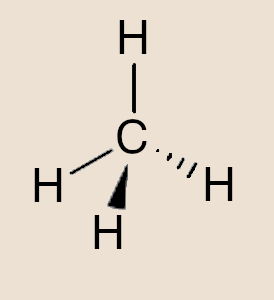
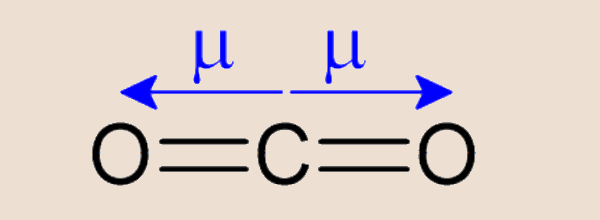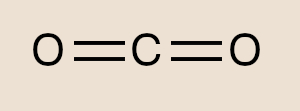As moléculas são entidades neutras formadas por, pelo menos, dois átomos, os quais devem estar ligados por meio de uma ligação covalente. Trata-se da menor partícula de um composto que possui as propriedades químicas desse composto. Elas podem ser classificadas de diversas formas, como, por exemplo, homonucleares, heteronucleares, polares, apolares, diatômicas, poliatômicas ou até mesmo como macromoléculas.
Leia também: O que é uma substância?
Tópicos deste artigo
- 1 - Resumo sobre molécula
- 2 - O que são moléculas?
- 3 - Tipos de moléculas
- 4 - Geometria molecular
- 5 - Polaridade das moléculas
- 6 - Exemplos de moléculas
- 7 - Diferenças entre molécula, átomo e substância
- 8 - Exercícios resolvidos sobre moléculas
Resumo sobre molécula
- Moléculas são entidades neutras que são formadas por, pelo menos, dois átomos.
- Para formar uma molécula, os átomos devem se ligar por meio de ligações covalentes.
- As moléculas podem ser classificadas como homonucleares, heteronucleares, polares, apolares, diatômicas, poliatômicas ou macromoléculas.
- Uma molécula adota um arranjo espacial específico, conhecido como geometria molecular, para ter maior estabilidade.
- A geometria de uma molécula afeta a polaridade dessa molécula, parâmetro que é de extrema importância para conhecer os tipos de interações que ocorrerão entre moléculas para a formação das diversas substâncias.
O que são moléculas?

Moléculas são entidades neutras formadas por, pelo menos, dois átomos, sendo que estes estão ligados por meio de uma ligação covalente. A molécula é a menor partícula de um composto que possui as propriedades químicas desse composto.
Tipos de moléculas
Existem algumas classificações possíveis para moléculas:
- Molécula diatômica homonuclear: é uma molécula formada por dois átomos do mesmo elemento químico. Exemplos: Cl2, H2, O2.
- Molécula diatômica heteronuclear: é uma molécula formada por dois átomos de elementos químicos diferentes. Exemplos: HCl, CO.
- Molécula poliatômica: é uma molécula formada por mais de dois átomos. Exemplos: O3, C12H22O12, HCN, CO2.
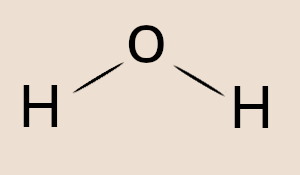
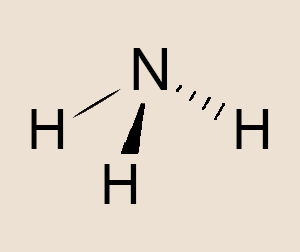
- Molécula polar: é uma molécula que tem o momento de dipolo elétrico diferente de zero. Exemplos: HCl, NH3, H2O.
- Molécula não polar ou apolar: é uma molécula que tem o momento dipolo elétrico igual a zero. Exemplos: O2, CO2, BF3.
- Macromolécula: é uma molécula muito grande, formada por centenas de átomos, com elevada massa molecular.
Geometria molecular
Para apresentarem menor repulsão eletrônica entre os pares de elétrons ligantes e não ligantes e, consequentemente, maior estabilidade, os átomos presentes nas moléculas adotam um arranjo espacial que conhecemos como geometria molecular.
Para a geometria molecular ser bem descrita, devemos nos basear na teoria da repulsão do par de elétrons da camada de valência, a RPECV. Nessa teoria, resumidamente, a geometria da molécula é consequência das repulsões eletrônicas que ocorrem entre pares de elétrons ligantes e não ligantes do elemento central da molécula.
A tabela a seguir traz as geometrias adotadas pelas moléculas com base na RPECV.
|
Total de pares elétrons do elemento central (ligantes + não ligantes) |
Número de par de elétrons ligantes vs. Número de par de elétrons não ligantes |
Geometria adotada pela molécula |
|
2 |
2 – 0 Não pare agora... Tem mais depois da publicidade ;)
|
Linear |
|
3 |
3 – 0 |
Trigonal plana |
|
2 – 1 |
Angular Não pare agora... Tem mais depois da publicidade ;)
|
|
|
1 – 2 |
Linear |
|
|
4 |
4 – 0 |
Tetraédrica |
|
3 – 1 Não pare agora... Tem mais depois da publicidade ;)
|
Piramidal |
|
|
2 – 2 |
Angular |
|
|
1 – 3 |
Linear |
|
|
5 Não pare agora... Tem mais depois da publicidade ;)
|
5 – 0 |
Bipirâmide trigonal |
|
4 – 1 |
Gangorra |
|
|
3 – 2 |
Forma de T Não pare agora... Tem mais depois da publicidade ;)
|
|
|
2 – 3 |
Linear |
|
|
6 |
6 – 0 |
Octaédrica |
|
5 – 1 Não pare agora... Tem mais depois da publicidade ;)
|
Pirâmide quadrada |
|
|
4 – 2 |
Quadrado planar |
|
|
7 |
7 – 0 |
Bipirâmide pentagonal Não pare agora... Tem mais depois da publicidade ;)
|
Vale destacar alguns pontos no modelo RPECV para melhor compreensão e utilização:
- Ligações múltiplas são contabilizadas como um único par ligante. É o caso do CO2, cuja estrutura é O=C=O. Nitidamente o carbono, elemento central, utiliza-se de 4 pares ligantes de elétrons. Contudo, por serem duas ligações duplas, o modelo RPECV “enxerga” como um único par ligante. Assim, o CO2 apresenta 2 pares de elétrons ligantes (pelo modelo RPECV) e, portanto, apresenta geometria linear.
- Os pares de elétrons não ligantes não devem ser contabilizados para se determinar a geometria. É o caso do H−Cl, por exemplo. Ao se estabelecer a ligação covalente, vê-se que o cloro fica com um par de elétrons ligante e mais três pares de elétrons não ligantes. Ao observar na tabela, quando temos 1 par de elétrons ligantes e mais 3 pares de elétrons não ligantes, a molécula adquire geometria linear, que é o caso do HCl.
Polaridade das moléculas
As ligações covalentes podem ser polarizadas ou não, uma consequência do efeito da eletronegatividade. Quando as ligações químicas são heteronucleares, ou seja, formadas por elementos distintos, a diferença de eletronegatividade faz com que os elétrons estejam mais próximos dos átomos mais eletronegativos da ligação.
A direção, o sentido e a intensidade dessa polarização são marcados por um vetor, chamado vetor polaridade µ. A região mais eletronegativa da ligação covalente adquire, assim, uma carga parcial negativa, enquanto o lado oposto desta adquire uma carga parcial positiva. Nesse caso, havendo o vetor polaridade (µ ≠ 0), pode-se dizer que a ligação covalente é polar.
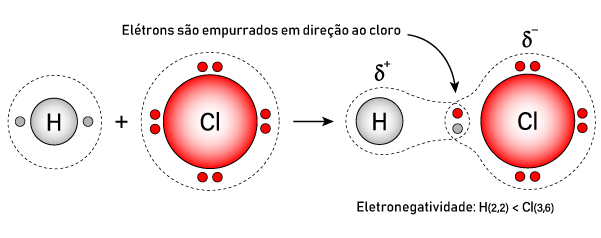
Nas ligações homonucleares, como não há diferença de eletronegatividade (visto que os elementos são os mesmos), não há polarização da ligação. Nesse caso, o vetor polaridade é nulo (µ = 0) e a ligação é dita apolar.
Em um primeiro momento, poderíamos pensar que, se uma molécula é feita de ligações polares, então a mesma molécula é polar. Mas isso não é verdade, pois a geometria da molécula pode anular esses vetores polaridade, como é o caso do CO2.
Perceba que o oxigênio, por ser mais eletronegativo que o carbono, tem o vetor polaridade apontado para si, indicando a direção e o sentido dos elétrons da ligação covalente. Porém, por conta da simetria dessa geometria molecular, os vetores apenas diferem no seu sentido e, portanto, ao se somarem, anulam-se. Como o vetor polaridade resultante (µR) é nulo, então a molécula é apolar.
Portanto, para a determinação da polaridade da molécula, devemos avaliar todas as ligações covalentes, sejam elas polares, sejam não. Se a resultante do vetor polaridade for nula, então a molécula é apolar. Do contrário, se a resultante do vetor polaridade for diferente de zero, então a molécula é polar.
Em geral, moléculas serão polares se apresentarem os seguintes critérios:
- se o elemento central apresentar pares de elétrons não ligantes; OU
- se as ligações covalentes forem com elementos diferentes.
Não obedecendo a esses critérios, a molécula será apolar.
Essa metodologia auxilia na determinação da polaridade de algumas moléculas, como, por exemplo:
|
Molécula |
H2O Não pare agora... Tem mais depois da publicidade ;)
|
HCN |
SO3 |
|
Elétrons não ligantes no elemento central? |
SIM |
NÃO |
NÃO Não pare agora... Tem mais depois da publicidade ;)
|
|
Ligações covalentes diferentes? |
NÃO |
SIM |
NÃO |
|
Polaridade |
Polar Não pare agora... Tem mais depois da publicidade ;)
|
Polar |
Apolar |
Exemplos de moléculas
- Água – H2O
- Gás oxigênio – O2
- Amônia – NH3
- Metano – CH4
- Dióxido de carbono – CO2
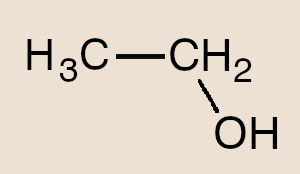
- Etanol – C2H6O
- Gás nitrogênio – N2
- Cianeto de hidrogênio – HCN
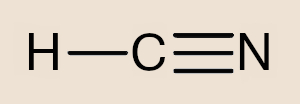
Diferenças entre molécula, átomo e substância
Átomo, molécula e substância são conceitos distintos envolvendo a matéria. Na verdade, de forma mais criteriosa, apresentam um aspecto de hierarquia na formação da matéria.
Os átomos são as partículas que darão origem às moléculas, quando estes se ligarem covalentemente. Portanto, uma molécula é formada a partir de dois ou mais átomos. O átomo é a base fundamental da composição da matéria, embora existam partículas ainda menores que ele, pois é a menor partícula de um elemento que tem as propriedades químicas desse elemento.
Já as moléculas, uma vez formadas, poderão interagir entre si e formar as substâncias, as quais podem ser simples (formadas apenas por moléculas homonucleares) ou compostas (formadas por moléculas heteronucleares). Assim, temos a hierarquia: átomos formam moléculas, moléculas formam substâncias.
As propriedades químicas das substâncias são consequência dos átomos envolvidos, enquanto as propriedades físicas das substâncias são consequência da forma que as moléculas irão interagir entre si.
Leia também: Quais as propriedades da matéria?
Exercícios resolvidos sobre moléculas
Questão 1. (UERJ/2025) Em um laboratório, com sistema fechado sob condições isobáricas, realizou-se o estudo da seguinte reação química:
3 O2 (g) ⇌ 2 O3 (g)
Ao longo do estudo, foram monitorados cinco parâmetros: volume, massa, pressão, quantidade de átomos e número de moléculas. Observe no gráfico a variação do volume em função do tempo:
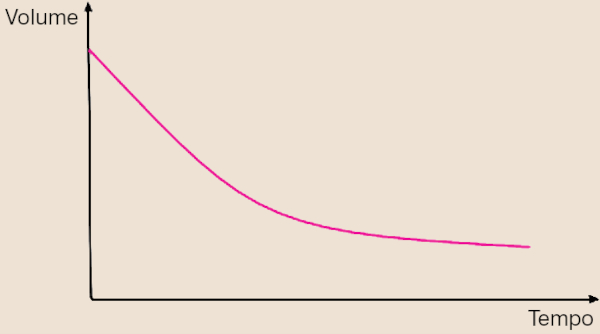
A variação do volume registrada decorre da redução do seguinte parâmetro monitorado:
A) massa
B) pressão
C) quantidade de átomos
D) número de moléculas
Resposta: Letra D.
Na reação, percebe-se que cada 3 moléculas de gás oxigênio (O2) convertem-se em 2 moléculas de gás ozônio (O3). Portanto, a queda do volume é decorrente da queda da quantidade de moléculas no sistema.
Questão 2. (FAME Medicina/2023.1) Os elementos do grupo 8A na tabela periódica eram chamados de gases inertes porque não reagiam com outras substâncias. No início dos anos 1960, cientistas descobriram que a energia de ionização do xenônio (Xe) seria baixa o suficiente para formar compostos, desde que o Xe reagisse com uma substância com habilidade extremamente alta para atrair elétrons de seu átomo. O xenônio pode, então, formar compostos moleculares, entre eles, um composto cristalino de geometria quadrática plana.
Nesse caso, qual é o cristal de xenônio possível de ser formado?
A) XeS2
B) XeCl6
C) XeF4
D) XeC4
Resposta: Letra C.
Para ser um quadrado planar, a quantidade de pares de elétrons não ligantes com pares de elétrons não ligantes deve ser igual a 6, de modo que 4 pares de elétrons sejam ligantes e 2 não sejam ligantes. O xenônio possui 8 elétrons na camada de valência. Desses 8, para formar a geometria quadrado planar, 4 não devem se ligar (formando os 2 pares de elétrons não ligantes), já os outros 4 devem participar de 4 ligações covalentes (formando os 4 pares de elétrons ligantes). Como há 4 elétrons para se ligar, por meio de 4 ligações covalentes simples, o átomo que se ligar ao xenônio deve se estabilizar com uma única ligação covalente. Nesse caso, entre as alternativas apresentadas, apenas o flúor se enquadra e, portanto, chegamos ao composto XeF4. Além disso, o flúor é o elemento mais eletronegativo da tabela periódica e, portanto, também se enquadra no critério de que o elemento a que se ligasse deveria ter uma habilidade extremamente alta para atrair elétrons.
Fontes
HOUSECROFT, C. E.; SHARPE, A. G. Inorganic Chemistry. 4. ed. Harlow (Inglaterra): Pearson Education Limited, 2012.
MIESSLER, G. L.; FISCHER, P. J.; TARR, D. A. Química Inorgânica. 5. ed. São Paulo: Pearson Education do Brasil, 2014.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, v. 66, n. 5, p. 1077-1184, 1994.