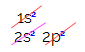Define-se como hibridização a união de orbitais atômicos incompletos. Um orbital é classificado como incompleto quando ele apresenta apenas um elétron em seu interior em vez de dois. Veja uma representação de um orbital incompleto e um orbital completo:
Não pare agora... Tem mais depois da publicidade ;)
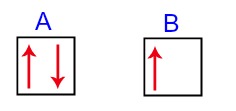
Na imagem A, temos um orbital completo; na imagem B, um orbital incompleto.
A hibridização é um fenômeno natural quee ocorre com alguns elementos químicos, como o Fósforo, o Enxofre, o Carbono etc. A hibridização do Carbono permite que os átomos desse elemento sejam capazes de realizar quatro ligações químicas, ou seja, o carbono só realiza quatro ligações após sofrer o fenômeno da hibridização.
Mas por que o carbono sofre hibridização e realiza quatro ligações? Para entender esse fenômeno, temos que conhecer a distribuição eletrônica desse elemento:
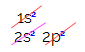
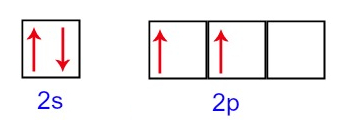
Na distribuição eletrônica do carbono, percebemos que o subnível 1s está completo (com dois elétrons), o 2s está completo (com dois elétrons) e o subnível 2p está incompleto (o subnível p suporta seis elétrons, mas há somente dois). Distribuindo os elétrons do 2p de forma representativa, temos que:
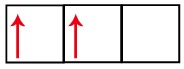
O subnível p apresenta três orbitais – no caso do carbono, dois deles estão incompletos e um está vazio. Por essa razão, esse elemento deveria realizar apenas duas ligações, já que o número de orbitais incompletos sempre determina o número de ligações.
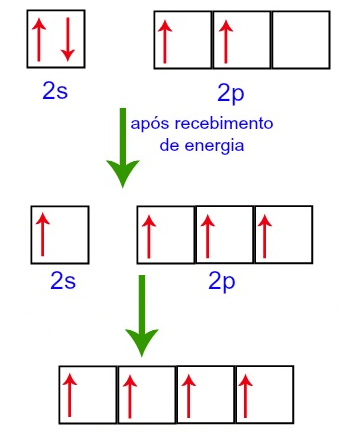
No entanto, ao receber energia do meio externo, os elétrons presentes no Carbono são excitados. Assim, um dos elétrons presentes no subnível 2s desloca-se para o orbital do subnível p que estava vazio:
Não pare agora... Tem mais depois da publicidade ;)
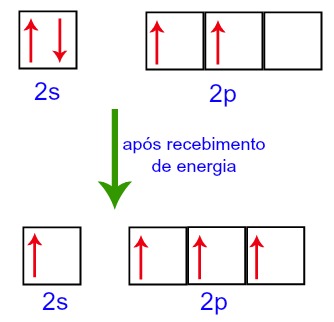
Orbitais do Carbono antes e após o recebimento de energia do meio externo
Assim sendo, o carbono fica com quatro orbitais incompletos no seu segundo nível. Em seguinda, o orbital do subnível 2s une-se aos três orbitais p, o que configura o fenômeno de hibridização.
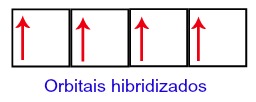
Orbitais do Carbono após hibridização
Por Me. Diogo Lopes Dias