Transformação isocórica (isovolumétrica)
Transformação isocórica (isovolumétrica) é um processo termodinâmico em que o volume se mantém o mesmo em um sistema fechado.
A transformação isocórica (isovolumétrica) é um processo termodinâmico que consiste na conservação do volume ainda que seja variada a temperatura ou a pressão do fluido. Nessa transformação, a pressão e a temperatura da amostra variam de maneira diretamente proporcional. Ela foi desenvolvida pelo Jacques Charles (1746-1823).
Leia também: Você sabe o que é transformação isotérmica?
Resumo sobre transformação isocórica (isovolumétrica)
- A transformação isocórica (isovolumétrica) é um processo termodinâmico que acontece quando os fluidos apresentam volume constante estando em um sistema fechado.
- Calculamos a transformação isocórica pela razão da pressão inicial e temperatura inicial igual à razão da pressão final e temperatura final.
- As transformações isotérmica, isobárica e isovolumétrica são tipos de transformações gasosas.
O que é transformação isocórica?
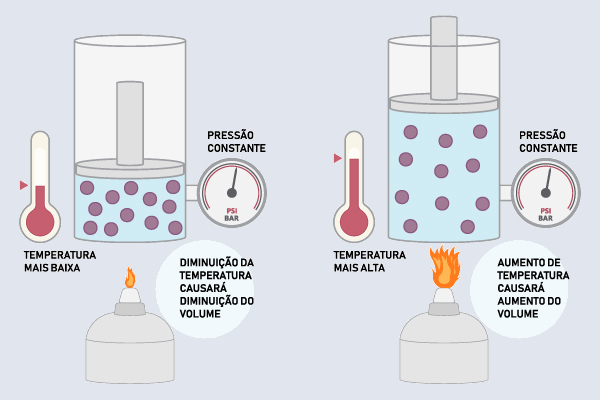
Também chamada por lei de Charles, a transformação isocórica (isovolumétrica) é uma transformação termodinâmica em que há preservação do volume, independentemente da modifição da pressão ou da temperatura do fluido. Ela foi formulada pelo polímata Jacques Alexandre César Charles (1746-1823) e pode ser enunciada como:
"Com volume constante, a pressão de determinada massa de gás é diretamente proporcional a sua temperatura absoluta, ou seja, a razão entre pressão e temperatura é uma constante."
Sua nomenclatura advém do grego isos, que significa igual, e khoros, que significa espaço, por isso isocórico significa mesmo espaço, volume igual, constante.
A transformação isocórica ocorre quando um gás ou líquido está em um sistema fechado, em que existem trocas de energia com a vizinhança, sob volume constante e em que se modifica a sua pressão e a sua temperatura.
Fórmula da transformação isocórica
→ Relação entre pressão, volume e temperatura
\(\frac{p_o \ \cdot \ V_o}{T_o} = \frac{p \ \cdot \ V}{T}\)
- po → pressão inicial, medida em Pascal [Pa].
- Vo → volume inicial, medido em metros cúbicos [m3].
- To → temperatura inicial, medida em Kelvin [K].
- p → pressão final, medida em Pascal [Pa].
- V → volume final, medido em metros cúbicos [m3].
- T → temperatura final, medida em Kelvin [K].
→ Transformação isocórica (isovolumétrica)
\(\frac{p_o}{T_o} = \frac{p}{T}\)
- po → pressão inicial, medida em Pascal [Pa].
- To → temperatura inicial, medida em Kelvin [K].
- p → pressão final, medida em Pascal [Pa].
- T → temperatura final, medida em Kelvin [K].
→ Trabalho de um gás em uma transformação isotérmica
W = 0
- W → trabalho do gás, medido em Joule [J].
Como calcular a transformação isocórica?
Na transformação isocórica calculamos a pressão e a temperatura iniciais e finais empregando a fórmula da transformação isocórica. Pensando nisso, selecionamos um exemplo abaixo:
- Exemplo:
Um gás em volume constante, e inicialmente numa temperatura de 283 K e sob pressão de 5 Pa, tem sua temperatura aumentada para 373 K. Em vista disso, qual a pressão final sobre o gás?
Resolução:
Calcularemos a pressão do gás empregando a fórmula que relaciona a pressão, o volume e a temperatura:
\(\frac{p_o \cdot V_o}{T_o} = \frac{p \ \cdot \ V}{T}\)
Como o volume é constante, podemos eliminá-lo, resultando na fórmula da transformação isocórica:
\(\frac{p_o}{T_o} = \frac{p}{T}\)
\(\frac{5}{283} = \frac{p}{373}\)
\(p = \frac{5 \ \cdot \ 373}{283}\)
\(p \cong 6,59 Pa\)
Acesse também: Você sabe o que é transformação adiabática?
Transformação isocórica, isobárica e isotérmica
As transformações isotérmica, isobárica e isovolumétrica são transformações gasosas com características distintas. Enquanto a transformação isocórica mantém apenas o volume constante ao longo do tempo, a transformação isobárica mantém a pressão constante, e a transformação isotérmica mantém a temperatura constante.
Exercícios resolvidos sobre transformação isocórica
Questão 1
(PUC) Um pneu de bicicleta é calibrado a uma pressão de 4 atm em um dia frio, à temperatura de 7 °C. Supondo que o volume e a quantidade de gás injetada são os mesmos, qual será a pressão de calibração nos dias em que a temperatura atinge 37 °C?
A) 21,1 atm
B) 4,4 atm
C) 0,9 atm
D) 760 mmHg
E) 2,2 atm
Resolução:
Alternativa B.
Primeiramente converteremos a temperatura da escala Celsius para a escala Kelvin:
7 °C + 273 = 280 K
37 °C + 273 = 310 K
Por fim, calcularemos a pressão do pneu empregando a fórmula da transformação isocórica:
\(\frac{p_i}{T_i} = \frac{p_f}{T_f}\)
\(\frac{4}{280} = \frac{p_f}{310}\)
\(p_f = \frac{310 \ \cdot \ 4}{280}\)
\(p_f \cong 4,4 \ atm\)
Questão 2
(Ufam) Analise as seguintes afirmativas a respeito dos tipos de transformações ou mudanças de estado de um gás.
I – em uma transformação isocórica o volume do gás permanece constante.
II – em uma transformação isobárica a pressão do gás permanece constante.
III – em uma transformação isotérmica a temperatura do gás permanece constante.
IV – em uma transformação adiabática variam o volume, a pressão e a temperatura.
Com a relação as quatro afirmativas acima, podemos dizer que:
A) só I e III são verdadeiras.
B) só II e III são verdadeiras.
C) I, II, III e IV são verdadeiras.
D) só I é verdadeira.
E) todas são falsas.
Resolução:
Alternativa C.
Todos os conceitos das transformações gasosas estão certos.
Fontes
HALLIDAY, David; RESNICK, Robert; WALKER, Jearl. Fundamentos da Física: Gravitação, Ondas e Termodinâmica (vol. 2). 10. ed. Rio de Janeiro, RJ: LTC, 2016.
NUSSENZVEIG, Herch Moysés. Curso de física básica: Fluidos, Oscilações e Ondas, Calor (vol. 2). Editora Blucher, 2015.
Fonte: Brasil Escola - https://brasilescolav3.elav.tmp.br/quimica/transformacao-isocorica.htm