Metais nobres
Os metais nobres são elementos resistentes à corrosão e oxidação devido à sua baixa reatividade. Ouro e prata são alguns metais nobres muito usados na fabricação de joias.
Os metais nobres são elementos metálicos caracterizados por sua resistência à corrosão e oxidação, além de possuírem propriedades físicas e químicas importantes, como alta condutividade elétrica e térmica. Contudo, sua relevância vai muito além dessas características. Imagine, por um momento, um mundo sem ouro, prata ou platina. Esses metais não apenas desempenham papéis cruciais em setores como a joalheria e a indústria eletrônica, como também são fundamentais em aplicações médicas, financeiras e até espaciais.
Leia também: O que são semimetais?
Resumo sobre metais nobres
- Metais nobres são elementos metálicos com alta resistência à corrosão e oxidação e de brilho metálico intenso.
- São considerados metais nobres: ouro (Au), prata (Ag), platina (Pt), paládio (Pd), ródio (Rh), irídio (Ir), ósmio (Os), rutênio (Ru), rênio (Re) e mercúrio (Hg).
- Os metais nobres apresentam baixa reatividade química, tornando-se estáveis mesmo em ambientes agressivos.
- Possuem alta condutividade elétrica e térmica.
- Apresentam maleabilidade e ductilidade, podendo ser moldados sem perder suas propriedades.
- São raros e de alto valor econômico, sendo usados em joias, catalisadores e equipamentos médicos.
- Têm elevados pontos de fusão e ebulição e densidade elevada.
- Nem todo metal nobre é precioso, como o rutênio e o ósmio, que não possuem alto valor comercial.
- A obtenção é por extração e concentração do minério, bem como refino e purificação.
O que são metais nobres?
Metais nobres são elementos metálicos que apresentam alta resistência à corrosão e oxidação, como é o caso do ouro, prata e platina, os quais são utilizados nos ramos de joalheria e eletrônica.
Quais são os metais nobres?
Os elementos da Tabela Periódica considerados metais nobres são:
- Ouro (Au)
- Prata (Ag)
- Platina (Pt)
- Paládio (Pd)
- Ródio (Rh)
- Irídio (Ir)
- Ósmio (Os)
- Rutênio (Ru)
- Rênio (Re)
- Mercúrio (Hg)
Embora não seja tradicionalmente classificado como nobre, o rênio é altamente resistente à corrosão e oxidação, especialmente em altas temperaturas. Por esse motivo, alguns autores o incluem na lista de metais nobres, principalmente em contextos industriais. Já o mercúrio é um caso especial, porquanto ele é líquido em temperatura ambiente e não sofre corrosão no sentido tradicional, mas pode reagir com outros elementos, como enxofre. Por isso, nem sempre é classificado como um metal nobre, embora apresente algumas características semelhantes.
Veja também: Quais são os metais alcalinos?
Características dos metais nobres
Os metais nobres têm características que os distinguem dos demais, como:
- Elevada resistência à oxidação e corrosão, pois permanecem estáveis mesmo em ambientes agressivos.
- Baixa reatividade química, isto é, dificilmente formam compostos ou sofrem degradação. Além disso, a reatividade química dos metais nobres está relacionada à sua resistência à oxidação e corrosão. Embora todos sejam considerados pouco reativos, há diferenças sutis que nos permite ordená-los em ordem crescente de reatividade:
Au < Pt < Ir < Rh < Ru < Os < Pd < Ag < Hg < Re
- Brilho metálico intenso, pois apresentam uma superfície brilhante e refletiva.
- Raridade na crosta terrestre, ou seja, são pouco abundantes, o que os torna ainda mais valiosos.
Propriedades dos metais nobres
As propriedades dos metais nobres são:
- elevado ponto de fusão e ebulição;
- densidade elevada;
- inércia química (não reagem facilmente com ácidos ou bases, sendo resistentes à corrosão);
- alta condutividade elétrica e térmica;
- ductilidade e maleabilidade.
Metais nobres x metais preciosos

Embora os termos “metais nobres” e “metais preciosos” sejam frequentemente usados como sinônimos, eles têm significados distintos. Por exemplo, como explicado em tópico anterior, os metais nobres são aqueles que apresentam alta resistência à oxidação e corrosão devido à sua baixa reatividade química; isto é, eles não reagem facilmente com o oxigênio ou com ácidos comuns, tornando-se altamente estáveis.
Por outro lado, os metais preciosos são aqueles que possuem elevado valor econômico e são raros na crosta terrestre. Embora a maioria dos metais preciosos seja também nobre, a classificação se baseia mais no valor comercial e na escassez do que na reatividade química. Ouro, prata e platina são os principais exemplos, mas metais como o ródio e o paládio também entram nessa categoria devido à sua alta demanda e custo.
Sendo assim, todo metal precioso pode ser nobre, mas nem todo metal nobre é necessariamente precioso, pois alguns, como o rutênio e o ósmio, embora nobres, não têm tanto valor comercial quanto o ouro e a platina.
Obtenção dos metais nobres
A obtenção dos metais nobres é um processo que exige técnicas avançadas devido à sua complexidade e resistência química, porquanto são encontrados em minérios, muitas vezes associados a sulfetos ou ligas metálicas. Desse modo, ocorre em várias etapas, que vão desde a extração até a purificação:
- Extração do minério: pode ser feita por mineração subterrânea ou a céu aberto, dependendo da localização e concentração do metal.
- Concentração do minério: após a extração, o minério passa por processos de separação para aumentar a concentração do metal desejado, em que técnicas como flotação, separação magnética e lixiviação são utilizadas para eliminar impurezas e isolar os metais nobres.
- Processos metalúrgicos: o minério concentrado é submetido a processos como fundição e eletrorrefino. A fundição ocorre em temperaturas elevadas para separar o metal puro dos resíduos. No caso do ouro e da prata, pode-se usar o processo de cianetação, enquanto os metais do grupo da platina são extraídos por refino químico e eletroquímico.
- Refino e purificação: em seguida, eles passam por refinamento para atingir altos graus de pureza. Técnicas como eletrólise, destilação e precipitação química garantem a eliminação de traços de impurezas.
Por fim, eles são moldados em barras, fios ou ligas conforme sua aplicação.
Importância dos metais nobres
A importância dos metais nobres está principalmente em suas aplicações, pois, como foi falado ao longo deste artigo, vimos que eles desempenham um papel fundamental na economia, na ciência e no cotidiano, tornando-se indispensáveis para o desenvolvimento do mundo contemporâneo. Sendo assim, podemos destacar alguns pontos relevantes:
- São usados na fabricação de componentes eletrônicos, como circuitos e conectores, devido à sua alta condutividade elétrica e resistência à corrosão.
- Ouro, prata e platina são utilizados na produção de joias e objetos de luxo, valorizados por seu brilho, durabilidade e raridade.
- Metais como platina, paládio e ródio são fundamentais na fabricação de catalisadores para indústrias químicas e automotivas, reduzindo emissões de gases poluentes.
- São empregados em equipamentos cirúrgicos, próteses e tratamentos odontológicos, pois apresentam biocompatibilidade e resistência à corrosão no organismo.
- São utilizados na fabricação de sensores, satélites, reatores nucleares e até em nanotecnologia, contribuindo para avanços científicos e tecnológicos.
Saiba mais: Por que objetos metálicos sofrem corrosão na praia?
Exercícios resolvidos sobre metais nobres
1) (Fuvest)
Um experimento expôs uma barra de titânio (Ti) pura e ligas desse material com 0,01% de diferentes metais nobres a soluções de ácido sulfúrico em ebulição para entender o efeito anticorrosivo desses metais no titânio. O resultado é mostrado na tabela a seguir:
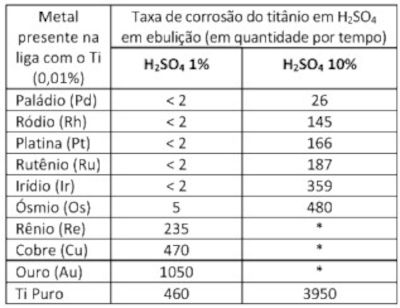
Com base nessas informações, é correto afirmar:
-
- O aumento na concentração de ácido sulfúrico nos experimentos fez com que o titânio puro fosse mais corroído e o titânio com Pd, Rh e Pt fosse menos corroído.
- Para Re, Cu e Au, espera-se que a reação com ácido sulfúrico mais concentrado demore muito para acontecer e, por isso, não foi possível medir.
- A escala de potencial anticorrosivo, segundo esse experimento, é dada por Au > Cu > Re > Os > Ir > Ru > Pt > Pd > Rh.
- Pd, Rh, Pt e Ru apresentaram os melhores resultados como anticorrosivos, enquanto Cu e Au apresentaram os piores.
- O titânio puro é muito resistente ao ácido, e a adição de outros metais não faz nenhuma diferença para a taxa de corrosão.
Resposta: D
Para uma melhor compreensão, vamos analisar cada alternativa:
a) ERRADO - Com o aumento da concentração do ácido sulfúrico, houve um aumento da corrosão, tanto do titânio puro quanto do titânio com Pd, Rh e Pt.
b) ERRADO - Com o aumento da concentração do ácido, espera-se a que o processo de corrosão ocorra mais rápido.
c) ERRADO - A escala de potencial anticorrosivo, segundo esse experimento, é dada por Au > Cu > Re > Os > Ir > Ru > Pt > Rh > Pd.
d) CORRETO - Basta comparar os valores da taxa de corrosão.
e) ERRADO - É possível notar que os metais nobres, por funcionarem como metais de sacrifício, reduzem a taxa de corrosão do titânio, quando comparado com o titânio puro.
2) Os metais nobres têm propriedades e características de grande valor para aplicações tecnológicas e industriais. Um exemplo disso é o paládio (Pd), um metal do grupo da platina, utilizado na indústria automotiva. Nesse contexto, assinale a alternativa correta sobre esses metais:
a) São altamente reativos e sofrem oxidação rápida quando expostos ao ar e à umidade.
b) Apresentam alta resistência química, o que os torna inertes em muitas reações, inclusive na catálise automotiva.
c) Possuem elevada condutividade elétrica e térmica, além de serem resistentes à corrosão, características que justificam seu uso em eletrônica e joalheria.
d) São encontrados em abundância na crosta terrestre, o que os torna economicamente acessíveis
para diversas aplicações industriais.
e) Apesar de sua baixa reatividade, não podem ser empregados em processos catalíticos devido à sua estabilidade química excessiva.
Resposta: C
a) ERRADA - Ao contrário dos metais comuns, os metais nobres são pouco reativos, o que os torna resistentes à oxidação e corrosão.
b) ERRADA - Embora sejam resistentes à corrosão, alguns metais nobres, como o paládio e a platina, são utilizados em catálise, pois têm a capacidade de acelerar reações químicas.
d) ERRADA - Os metais nobres são raros na crosta terrestre.
e) ERRADA - Apesar de serem estáveis, muitos metais nobres, como platina, paládio e ródio, são utilizados como catalisadores justamente por sua capacidade de facilitar reações sem sofrer degradação significativa.
Fontes
BOYLE, R. W. (Ed.). Noble Metals and Biological Systems: Their Role in Medicine, Mineral Exploration, and the Environment. Boca Raton: CRC Press, 1992.
CALLISTER, W. D.; RETHWISCH, D. G. Materials Science and Engineering: An Introduction. 10. ed. Hoboken: Wiley, 2018.
CRUNDWELL, F. K. et al. Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals. Oxford: Elsevier, 2011.
GREENWOOD, N. N.; EARNSHAW, A. Chemistry of the Elements. 2. ed. Oxford: Butterworth-Heinemann, 1997.
L. BROWN, T. et al. A série de atividades. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 143–144.
REEDIJK, J.; POEPPELMEIER, K. R. (Ed.). Comprehensive Inorganic Chemistry II. 2. ed. Amsterdam: Elsevier, 2013.
SCERRI, E. R. The Periodic Table: Its Story and Its Significance. Oxford: Oxford University Press, 2007.
Fonte: Brasil Escola - https://brasilescolav3.elav.tmp.br/quimica/metais-nobres.htm