Estudo dos gases é uma seção bem particular da Física e da Química, destinada a estudar o comportamento de substâncias no estado gasoso. É possível, através da lei de Clapeyron, relacionar as principais grandezas de um gás: temperatura, pressão e volume. Partindo dessa lei, também é possível estabelecer inúmeras relações entre essas grandezas. Assim, a depender do comportamento de suas principais grandezas, os gases podem ser separados em dois tipos principais: gases reais e gases ideais.
Leia também: Como ocorrem as transformações gasosas
Tópicos deste artigo
- 1 - Resumo sobre estudo dos gases
- 2 - O que é o estudo de gases?
- 3 - Fórmulas do estudo dos gases
- 4 - Tipos de gases
- 5 - Exercícios resolvidos sobre estudo dos gases
Resumo sobre estudo dos gases
- Estudo dos gases é o ramo da Física e da Química responsável pela compreensão dos gases e suas aplicações.
- A principal lei matemática do estudo de gases é a equação de Clapeyron.
- Existem dois tipos de gases distintos: reais e ideais.
- Gases reais são aqueles que existem na natureza.
- Gases ideais são um modelo teórico usado para descrever as moléculas de um gás.
- Essa classificação é feita a depender do comportamento das principais grandezas do gás.
- As principais grandezas de um gás são temperatura, pressão e volume.
O que é o estudo de gases?
É um ramo da Física (e da Química) fundamental para estudar o comportamento de substâncias que se encontram no estado gasoso. Tem como objetivo principal compreender como as três variáveis de estado de um gás se relacionam entre si: pressão, volume e temperatura.
Para simplificar o estudo dos gases, usa-se um modelo teórico conhecido por gás ideal. Nesse modelo em questão, as moléculas que compõem o gás são tratadas como elementos pontuais e suas colisões são tratadas como elásticas, ou seja, sem a dissipação de energia mecânica cinética.
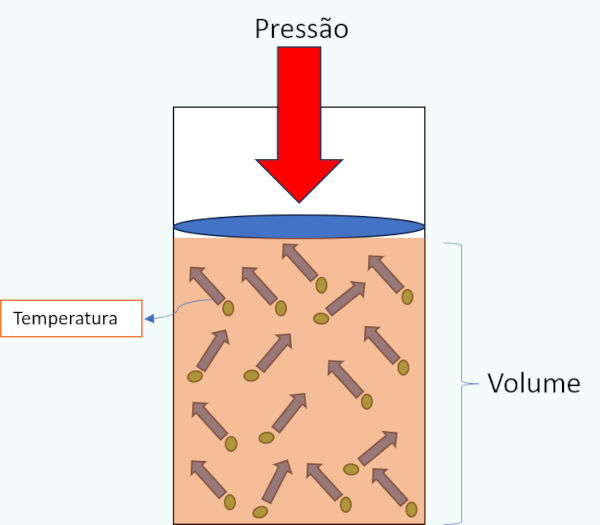
Desse modo:
- a pressão é compreendida pela ação de forças sobre as paredes que confinam o gás;
- o volume é o espaço físico ocupado pelo gás no recipiente; e
- a temperatura está relacionada com o movimento e a energia cinética das moléculas.
Veja também: Quais são as três principais leis dos gases?
Fórmulas do estudo dos gases
No estudo dos gases, é possível estabelecer a relação entre as três principais grandezas de um gás através de algumas leis. A principal delas é a equação de Clapeyron.
→ Equação de Clapeyron
\(P\cdot V=n\cdot R\cdot T\)
Sendo:
- P – pressão (atm)
- V – volume (L)
- n – número de mols (mols)
- T – temperatura (K)
- R – constante universal dos gases ideais (atm.L/mol.K)
-
Videoaula sobre equação de Clapeyron
Caso haja uma transformação de estado sofrida por um gás, em que sua pressão, volume ou temperatura sofra alguma variação, é possível utilizar a lei geral dos gases ideais.
→ Lei geral dos gases ideais
\(\frac{P\cdot V}{T}=n\cdot R\), logo, em uma transformação gasosa, não haverá nenhuma mudança no número de mols ou na natureza do gás.
Portanto:
\(\frac{P_0\cdot V_0}{T_0}=\frac{P_f\cdot V_f}{T_f}\)
Sendo:
- P0 – pressão inicial do gás (atm) // Pf – pressão final do gás (atm)
- V0 – volume inicial do gás (L) // Vf – volume final do gás (L)
- T0 – temperatura inicial do gás (K) // Tf – temperatura final do gás (K)
No caso de a transformação ocorrer com alguma das suas grandezas, sem qualquer alteração, teremos:
-
Lei de Boyle — transformação isotérmica
\(\frac{P_0\cdot V_0}{1}=\frac{P_f\cdot V_f}{1}\)
-
Lei de Charles — transformação isobárica
\(\frac{V_0}{T_0}=\frac{V_f}{T_f}\)
-
Lei de Gay-Lussac — transformação isométrica
\(\frac{P_0}{T_0}=\frac{P_f}{T_f}\)
Tipos de gases
A principal forma de compreender a natureza dos gases está na abordagem conceitual sob a qual as suas moléculas são descritas. Dessa forma:
-
Gases ideais
São uma abstração teórica para descrever as moléculas de um gás. Nesse caso, todas as partículas são tratadas como elementos infinitesimais, com volume desprezível em comparação ao recipiente, sem forças (atrativas e repulsivas) entre elas. As moléculas se movem de forma caótica, sem perda de energia cinética no choque com a superfície. Isso garante que a lei de Clapeyron se mantenha constante para qualquer estado de temperatura, pressão e volume do gás.
-
Gases reais
São gases que existem na natureza, como oxigênio ou ozônio. Ao contrário dos gases ideais, em determinados valores de pressão e temperatura, o volume das moléculas deixa de ser desprezível perante o volume do recipiente, passando a realizar ações de atração e repulsão intermoleculares.
Saiba mais: Lei de Boyle — o que ela afirma sobre os gases?
Exercícios resolvidos sobre estudo dos gases
1. (Pucrj 2023) Em um processo isobárico, a temperatura inicial de uma amostra de gás ideal é 300 K. Se o volume dessa amostra triplica durante o processo, qual será, em K, o valor da temperatura final do gás?
a) 900.
b) 600.
c) 300.
d) 100.
e) 0.
Resposta: A.
Aplicando a equação geral dos gases, obtemos:
\(\frac{P_1\cdot V_1}{T_1}=\frac{P_2\cdot V_2}{T_2}\\ \frac{V_1}{T_1}=\frac{V_2}{T_2}\\ \frac{V_1}{300}=\frac{3\cdot V_1}{T_2}\\ \therefore T_2 = 900K\)
2. (Esc. Naval 2023) A pressão manométrica de um pneu de automóvel é de 205 kPa antes de iniciar uma viagem em um local onde a pressão atmosférica é de 95 kPa e a temperatura é de 25°C (considere que o ar no interior do pneu está em equilíbrio térmico com o meio externo). Ao término da viagem, a pressão manométrica verificada no mesmo pneu foi de 225 kPa, em uma cidade onde a pressão atmosférica é de 105 kPa. Admitindo que o comportamento do ar seja igual ao comportamento de um gás ideal e sabendo que o volume do pneu aumentou em 5%, assinale a opção que apresenta a melhor aproximação para a temperatura do ar do pneu medida após o término da viagem.
a) 29°C.
b) 35°C.
c) 44°C.
d) 71°C.
e) 85°C.
Resposta: D.
Utilizando a equação geral dos gases e lembrando que P = Pm + Patm, obtemos:
\(\frac{P_1\cdot V_1}{T_1}=\frac{P_2\cdot V_2}{T_2}\\ \frac{(205+95)\cdot V_1}{25+273}=\frac{(225+105)\cdot 1,05}{T_2}\\ \frac{300}{298}=\frac{330\cdot 1,05}{T_2}\\ \therefore T_2 = 344,19K \cong 71º C\)
3. (Ufu 2022) Um gás ideal satisfaz a equação \(\frac{P_1\cdot V_1}{T_1}=\frac{P_2\cdot V_2}{T_2}\), onde P denota pressão, V denota volume e T denota temperatura em Kelvins. Isso significa que, em um processo
a) adiabático, a temperatura é inversamente proporcional ao volume.
b) isotérmico, a pressão é diretamente proporcional ao volume.
c) isobárico, a temperatura é diretamente proporcional ao volume.
d) isométrico, a pressão é inversamente proporcional à temperatura.
Resposta: C
Comentário: A equação em questão apresenta as variáveis pressão e volume inversamente proporcionais para um processo isotérmico; pressão ou volume com temperatura são diretamente proporcionais para processos isocóricos ou isobáricos respectivamente. Logo, a alternativa correta é a C.
Fontes
HALLIDAY, David; RESNICK, Robert; WALKER, Jearl (colab.). Fundamentos de física: gravitação, ondas e termodinâmica, volume 2. 10. ed. Rio de Janeiro: LTC - Livros Técnicos e Científicos, 2016.
HEWITT, P. G. Física conceitual. 9. ed. Porto Alegre: Bookman, 2002.

